双荧光素酶报告基因检测试剂盒 (高通量)说明书
双荧光素酶报告基因检测试剂盒 (高通量)说明书
产品详情
|
货号
|
规格
|
价格
|
|
78EA10008-100T
|
100T
|
¥1,440.00
|
产品描述
报告基因检测常用于研究真核生物基因表达调控,萤火虫萤光素酶 和海肾萤光素酶可以分别催化底物萤光素(luciferin)和腔肠素(coelenterazine)发出生物萤光(bioluminescence),这种发光反应具有良好的光学特征和浓度线性范围,同时检测的灵敏度高,可达到 10-20mol。两种催化反应最适浓度不同,因此互不干扰, 配合使用形成一套高灵敏的双荧光素酶报告基因检测系统,其中海肾萤光素酶常作为内参照。
萤火虫萤光素酶是一种分子量约为 61 kDa 的蛋白,在 ATP、镁离子和氧气存在的条件下,催化 luciferin 氧化成 oxyluciferin,在此过程中会发出波长约为 560 nm 的生物萤光。海肾萤光素酶是一种分子量约为 36 kDa 的蛋白,在氧气存在的条件下,催化腔肠素(Coelenterazine)氧化成 coelenteramide,在此过程中会发出波长约为 480 nm 的生物萤光。在后加入海肾萤光素酶底物时,可有效淬灭萤火虫荧光素酶催化 luciferin 的发光,而不干扰海肾萤光素酶的活性,从而实现双萤光素酶报告基因检测。生物萤光可以通过化学发光仪(luminometer)或)或多功能酶标仪进行测定。通过萤光素酶与其底物催化发光的体系,可以高效、灵敏地检测基因的表达。检测原理如图所示:
图 1.荧光素酶报告基因反应原理图
产品组成
试剂盒组分:
|
名称
|
规格
|
保存条件
|
|
5x Universal lysis Buffer(ULB)
|
20 mL
|
-20℃
|
|
Fluc Buffer A
|
5 mL
|
-20℃
|
|
Fluc substrate
|
干粉
|
-20℃
|
|
Rluc Buffer B
|
干粉 5 mL
|
-20℃
|
|
50x Rluc substrate
|
100 μL
|
-20℃
|
运输与保存
冰袋运输,-20℃保存 6 个月,-80℃保存更长时间。
实验步骤
1. 试剂准备:
(1)1x Universal lysis Buffer(ULB)配置:取所需体积的 5x Universal lysis Buffer 临用前用三蒸水稀释至1x;
(2)Fluc buffer A 工作液:试剂盒开始启用时,将 Fluc buffer A 全部加入到 Fluc substrate 中,适当吹打摇匀至粉末充分溶解后,分装到棕色管中-20℃保存备用;
(3)Rluc Buffer B 工作液:临用前取 50x Rluc substrate 用 Rluc Buffer B 稀释至 1x 用(按需配置),配置好的 Rluc Buffer B 工作液在 2-3 h 内使用有效(试剂配置过程中注意避光)。
2. 细胞裂解:
(1) 细胞裂解:取出孔板放置至恢复室温,加入适量体积 1x ULB 振荡器摇匀,室温裂解 15min。细胞裂解液推荐使用量:
|
细胞培养板型号
|
96 孔板
|
24 孔板
|
12 孔板
|
6 孔板
|
|
1x Universal lysis Buffer(ULB)/孔
|
30 μL
|
60 μL
|
80 μL
|
120 μL
|
(2) 荧光酶标仪设定,正确开启仪器,点击检测,选择生物发光检测功能,根据本批样本的灵敏度选择合适增益与积分时间,默认为增益 135,积分时间 10 s。
3. 检测:
1)移液枪吹打混匀裂解液后,吸取 20 μL 到黑色孔板底部。(样品数量过多时候建议使用移液枪经转移和后续加液操作,若使用四周不透光的培养板可省略转移操作)
2)向每孔中加入 100 μL Fluc buffer A,轻柔快速吹打混匀三次后,室温孵育反应 5-10min 后,上机检测记录发光值(F 值)。
3)向每孔中加入 100 μL Rluc buffer B,轻柔快速吹打混匀三次后,室温孵育反应 5-10min 后,上机检测记录发光值(R 值)。
(为保证结果准确性,在加入 Fluc buffer A 或Rluc buffer B 后,请在 1h 内完成检测)
实验案例分析
在 96 孔板中接种适量细胞过夜至贴壁状态,第二天进行如下转染:1.含有FXR 基因启动子区的荧光素酶报告基因表达载体质粒;2.含有 FXR 基因启动子区转录因子 E2 功能的重组表达载体质粒;3.海参荧光素酶重组表达载体质粒。转染 6h 向每孔中加入不同单体药物培养 48h,其中设置空白溶剂 DMSO 组。最后按试剂盒说明书操作裂解随后进行荧光素酶报告基因活性检测,结果如下(对应孔中所标白色字体数值为阳性激动剂的激动倍数)
图 3 . 59 种单体药物对X 基因启动子区荧光素酶报告基因激动倍数热图(A1:为空白溶剂对照组;A2-J6: 59
种 FDA 上市药物的实验组)
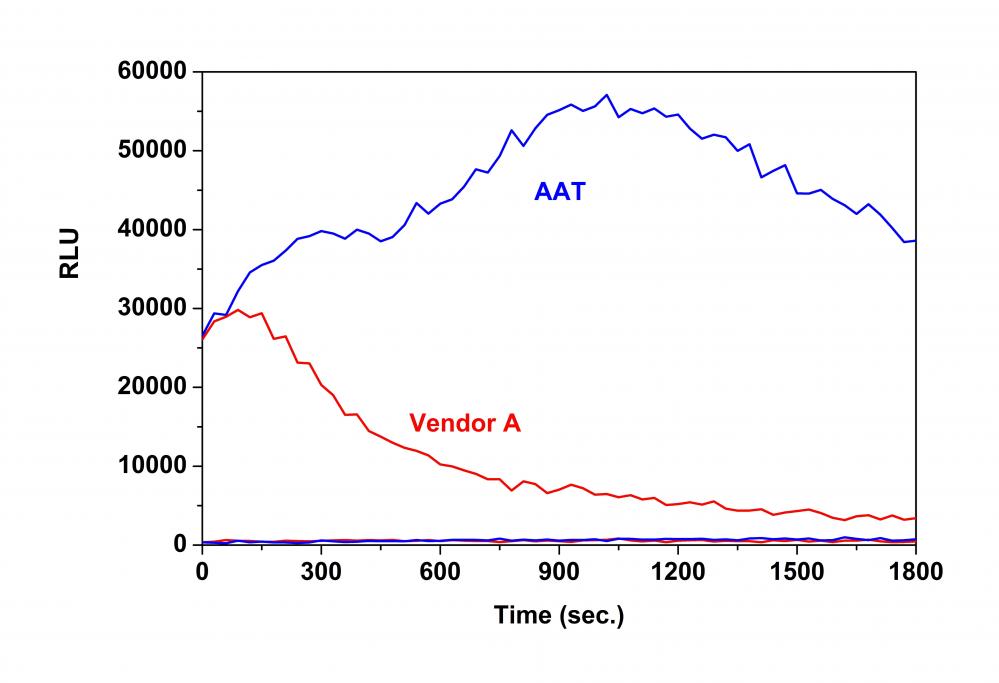
经过上述实验的高通量筛选确定 F3 孔对应单体药物对FXR 启动子区激动效果强,激动倍数为 45。同某进口“P“品牌一同测定该药物对FXR 基因的激动曲线,并计算 EC50,结果如下:
图 4.红色:金畔生物品牌测定 F3 单体药物激动 FXR 基因启动子区荧光素酶报告基因响应曲线;黄色:进口“P“品牌测定F3 单体药物激动 FXR 基因启动子区荧光素酶报告基因响应曲线(EC50)
1. 数据分析:
(1)实验设计:根据实验目的,每组实验均应设置空白对照组,对照组和处理组。
a. 空白对照组
背景 F:未转染细胞裂解液+ Fluc buffer A。
背景 R:未转染细胞裂解液+ Fluc buffer A + Rluc buffer B。
注:空白对照组样品量须与实验样品量相同,且与实验样品含有相同的培养基/血清组合。
b. 对照组:转染细胞未经实验因素处理 (即对照组 F 和对照组 R)。
c. 实验组:转染细胞经实验化合物处理 (即实验组F 和实验组 R)。
计算结果:对照组比值=(对照组 F-背景 F)/(对照组 R-背景 R),实验组比值=(实验组 F-背景 F)/(实验组 R-背景 R)。
表达倍数= 实验组比值/对照组比值。
注意事项
(1) 反应温度:酶促反应对温度较为敏感,加样检测前务必将检测试剂以及细胞培养液平衡至室温(20–25℃)。
(2) 检测仪器:能检测化学发光的仪器都适用,但由于不同仪器的设置和灵敏度不同,测得的光信号值也会不同。 检测板:为防止孔间干扰,推荐使用不透光酶标板。
(3) 发光信号会受到检测环境如培养基组分、温度等影响,应确保同组内不同样本检测条件一致。
(4) 为了您的安全和健康,请穿实验服并戴一次性手套。
(5) 本产品仅作科研用途!