上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Amplite 荧光法谷胱甘肽过氧化物酶检测试剂盒 红色荧光
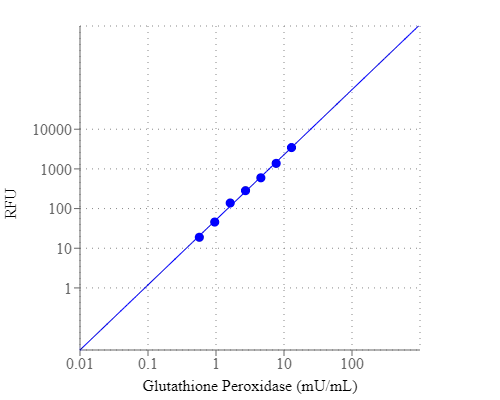 |
货号 | 11560 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 200 Tests | 价格 | 3924 | |
| Ex (nm) | 420 | Em (nm) | 480 | |
| 分子量 | 溶剂 | |||
| 产品详细介绍 | ||||
简要概述
Amplite 荧光法谷胱甘肽过氧化物酶检测试剂盒 红色荧光 是美国AAT Bioquest生产的检测谷胱甘肽过氧化物酶的试剂盒,谷胱甘肽过氧化物酶(GPx)是具有过氧化物酶活性的酶家族,以保护生物体免受氧化损伤。GPx在将有机氢过氧化物(例如脂质氢过氧化物)还原成其相应的醇或将游离过氧化氢还原成水。因此,它可以防止细胞膜和细胞中其他氧化剂敏感位点的氧化损伤。现在科研已经注意到,改变GPx水平与由许多评论和复杂疾病引起的损伤相关。在生物样品中测量GPx水平,作为潜在治疗癌症,糖尿病,神经退行性疾病和心血管疾病的潜在指标。AAT Bioquest的荧光谷胱甘肽过氧化物酶检测试剂盒提供灵敏的荧光测定法,用于测量生物样品中的GPx水平。该测定基于GPx催化的谷胱甘肽(GSH)氧化成氧化型谷胱甘肽(GSSG)。生成的GSSG通过谷胱甘肽还原酶(GR)和NADPH再循环至还原态GSH:
R-O-O-H + 2GSH GPx R-O-H + GSSG + H2O
GSSG + NADPH + H+ GR 2GSH + NADP+
产品NADP +可以使用我们新开发的专有NADP传感器Quest Fluor™NADP Probe进行专门监控。 NADP传感器仅与NADP反应产生荧光产物。 荧光信号可以用荧光酶标仪在Ex / Em = 420 / 480nm处测量,其与GPx活性成正比。与测量NADPH在340 nm处吸光度降低的其他商业试剂盒相比,我们的Quest Fluor™NADP探针可用于直接量化NADP水平。通过这种荧光测定GPx测定,我们能够在155μL反应体积中检测低至1.2 mU / mL的GPx。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的Amplite 荧光法谷胱甘肽过氧化物酶检测试剂盒。
适用仪器
| 荧光酶标仪 | |
| 激发: | 420nm |
| 发射: | 480nm |
| cutoff: | 430nm |
| 推荐孔板: | 黑色孔板 |
产品说明书
96孔板的测定方案
概述
准备GPx分析混合物(50μL)
添加GPx标准品或测试样品(50μL)
在室温下孵育30分钟
加入20μLQuestFluor™NADP探针
添加20μLNAP检测溶液
在室温下孵育10-20分钟
添加15μL增强剂
溶液在室温孵育30-60分钟,在Ex / Em = 420 / 480nm处记录荧光
注意1.为了获得最佳效果,强烈建议使用黑色版。
注意2.在开始实验之前,在室温下解冻每个试剂盒组分的一个小瓶。
操作方法
1.制备谷胱甘肽过氧化物酶(GPx)标准储备液:
将50μLddH2O或1×PBS缓冲液加入到GPx标准品(组分A)的小瓶中,制成10U / mL标准储备溶液。
注意:未使用的GPx标准储备溶液应分为单次使用的等分试样并储存在-20ºC。
2.准备GPx标准的系列稀释液:
2.1将4μLGPx标准储备溶液(10U / mL,来自步骤1)加入996L 1×PBS缓冲液中,以产生浓度为40mU / mL的标准溶液。
注意:稀释的GPx标准溶液不稳定,应在4小时内使用。
2.2取200μL40mU / mL GPx标准溶液进行1:2连续稀释,得到大约20,10,5,2.5,1.25,0.625和0 mU / mL的GPx标准品系列稀释液。
2.3如表1和2中所述,将GPx标准品和含有GPx的测试样品的系列稀释液加入到固体黑色96孔微量培养板中。
表1实心黑色96孔微孔板中GPx标准品和测试样品的布局
|
BL |
BL |
TS |
TS |
…. |
…. |
|
|
|
|
|
|
|
GP 1 |
GP 1 |
…. |
…. |
…. |
…. |
|
|
|
|
|
|
|
GP 2 |
GP 2 |
|
|
|
|
|
|
|
|
|
|
|
GP 3 |
GP 3 |
|
|
|
|
|
|
|
|
|
|
|
GP 4 |
GP 4 |
|
|
|
|
|
|
|
|
|
|
|
GP 5 |
GP 5 |
|
|
|
|
|
|
|
|
|
|
|
GP 6 |
GP 6 |
|
|
|
|
|
|
|
|
|
|
|
GP 7 |
GP 7 |
|
|
|
|
|
|
|
|
|
|
注意:GP = GPx标准,BL =空白对照,TS =测试样品。
表2每个孔的试剂组成
|
GPx Standard |
Blank Control |
Test Sample |
|
Serial Dilutions*: 50 μL |
1×PBS Buffer : 50 μL |
50 μL |
*注意:将连续稀释的GPx标准品从大约0.6 mU / mL加到40 mU / mL,一式两份加入GP1到GP7的孔中。
3.准备GSH原液(100X):
将100μlddH2 O加入到GSH小瓶(组分D)中以制备100X GSH储备溶液。
4.准备GPx底物储备液(100X):
将100μlddH2O加入到基质小瓶(组分E)中以制备100X底物储备溶液。
5.准备GPx分析混合物:
5.1将5 mL测定缓冲液(组分B)加入一瓶酶混合物(组分C)中。
5.2将50μLGSH储备溶液(来自步骤3的组分D),50μL底物储备溶液(组分E,来自步骤4)加入到组分B + C的瓶子中(来自步骤5.1),并充分混合以进行GPx测定 混合物(组分B + C + D + E)。
注1:该GPx测定混合物足以用于一个96孔板。 它不稳定,请及时使用。
注2:不建议储存未使用的GPx分析混合物。 可以将未使用的组分B + C混合物(来自步骤5.1)分成单次使用的等分试样并储存在-20ºC,尽管灵敏度可能会降低。
注3; 将未使用的100X GSH储备溶液(来自步骤3)和100X GPx底物储备溶液(来自步骤4)分成单次使用的等分试样并储存在-20ºC。
6.运行GPx分析:
6.1将50μLGPx测定混合物(来自步骤5.2)加入到GPx标准品,空白对照和测试样品的每个孔中(参见步骤2.3),使总体积为100μL/孔。
注意:对于384孔板,每孔加入25μL样品和25μLGPx测定混合物。
6.2在室温下孵育反应30分钟,避光。
7.运行NADP测定:
7.1将20μLQuestFluor™NADP探针(组分F)加入到GPx标准品,空白对照品和测试样品的每个孔中,充分混合。
7.2在每个孔中加入20μLNAP检测溶液(组分G),充分混匀。
注意:对于384孔板,每孔加入25μL样品和10μLQuestFluor™NADP探针(组分F)和10μLNAP检测溶液(组分G)。
7.3在室温下孵育反应10-20分钟,避光。
7.4向每个孔中加入15μL增强剂(组分H),使总测定体积为155μL/孔,并在室温下孵育30-60分钟,避光。
注意:对于384孔板,添加7.5μL增强剂。
7.5使用荧光读板仪在Ex / Em = 420/480 nm处监测荧光增加。
参考文献
A mechanistic mathematical model for the catalytic action of glutathione peroxidase
Authors: Pannala VR, Bazil JN, Camara AK, Dash RK.
Journal: Free Radic Res (2014): 487
A supramolecular microgel glutathione peroxidase mimic with temperature responsive activity
Authors: Yin Y, Jiao S, Lang C, Liu J.
Journal: Soft Matter (2014): 3374
Basal levels of glutathione peroxidase correlate with onset of radiation induced lung disease in inbred mouse strains
Authors: Kunwar A, Haston CK.
Journal: Am J Physiol Lung Cell Mol Physiol (2014): L597
Can recombinant human glutathione peroxidase 1 with high activity be efficiently produced in Escherichia coli
Authors: Guo X, Song J, Yu Y, Wei J.
Journal: Antioxid Redox Signal (2014): 1524
Changes of the Thioredoxin System, Glutathione Peroxidase Activity and Total Antioxidant Capacity in Rat Brain Cortex During Acute Liver Failure: Modulation by L-histidine
Authors: Ruszkiewicz J, Albrecht J.
Journal: Neurochem Res. (2014)
Characterization and structural analysis of human selenium-dependent glutathione peroxidase 4 mutant expressed in Escherichia coli
Authors: Yu Y, Song J, Guo X, Wang S, Yang X, Chen L, Wei J.
Journal: Free Radic Biol Med (2014): 332
Characterization of biochemical properties of a selenium-independent glutathione peroxidase of Cryptosporidium parvum
Authors: Kang JM, Ju HL, Sohn WM, Na BK.
Journal: Parasitology (2014): 570
Clinical significance and therapeutic value of glutathione peroxidase 3 (GPx3) in hepatocellular carcinoma
Authors: Qi X, Ng KT, Lian QZ, Liu XB, Li CX, Geng W, Ling CC, Ma YY, Yeung WH, Tu WW, Fan ST, Lo CM, Man K.
Journal: Oncotarget. (2014)
Construction of a highly stable artificial glutathione peroxidase on a protein nanoring
Authors: Miao L, Zhang X, Si C, Gao Y, Zhao L, Hou C, Shoseyov O, Luo Q, Liu J.
Journal: Org Biomol Chem (2014): 362
Daily rhythms of catalase and glutathione peroxidase expression and activity are endogenously driven in the hippocampus and are modified by a vitamin A-free diet
Authors: Navigatore-Fonzo LS, Delgado SM, Gimenez MS, Anzulovich AC.
Journal: Nutr Neurosci (2014): 21
