-
- 产品货号:
- JPSR70
-
- 中文名称:
- 镍-琼脂糖凝胶 6FF
-
- 英文名称:
- Ni Sepharose 6FF
-
- 品牌:
- Jinpan
-
货号
产品规格
售价
备注
-
JPSR70-10mL
10mL
¥460.00
亲和层析填料
-
JPSR70-25mL
25mL
¥1000.00
亲和层析填料
-
JPSR70-100mL
100mL
¥3300.00
亲和层析填料
产品描述
1 简介
金属螯合亲和层析介质,又称固定金属离子亲和色谱,其原理是利用蛋白质表面的一些氨基酸,如组氨酸能与多种过渡金属离子如Cu2+,Zn2+,Ni2+,Co2+,Fe3+发生特殊的相互作用,能够吸附富含这类氨基酸的蛋白质,从而达到分离纯化的目的。因此,偶联这些金属离子的琼脂糖凝胶就能够选择性地分离出这些含有多个组氨酸的蛋白以及对金属离子有吸附作用的多肽、蛋白和核苷酸。一般来说,Ni2+是用于纯化组氨酸标记的蛋白质的优选金属离子。半胱氨酸和色氨酸也能与固定金属离子结合,但这种结合力要远小于组氨酸残基与金属离子的结合力。镍亲和层析介质具有特异性好、流速快的优点,非常适合放大生产。
2 性能参数
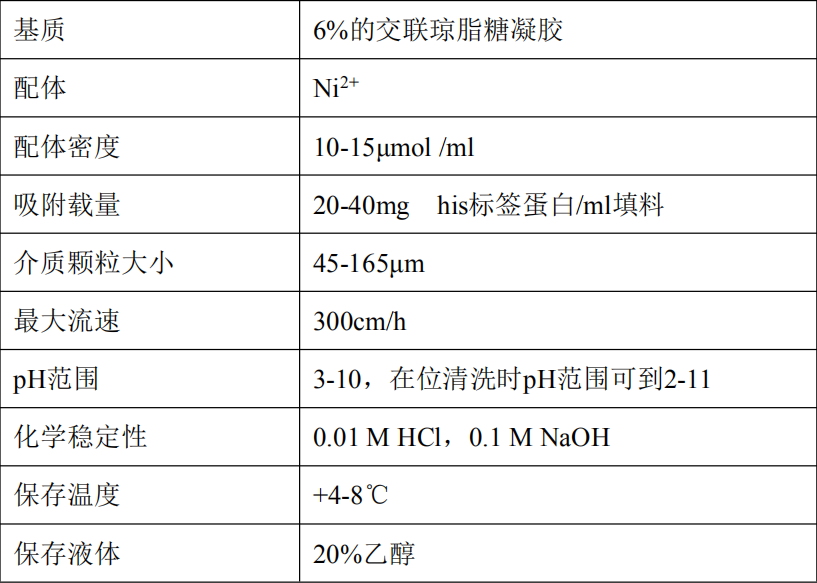
*检测条件: 层析柱 16mm×200mm *柱床高 5cm,25℃
3 使用方法
Ni 琼脂糖凝胶6FF预先偶联Ni2+离子。通常,Ni2+是用于纯化重组组氨酸标签蛋白的优选金属离子,用咪唑进行洗脱。
我们建议在含0.5-1.0 M NaCl的缓冲液,中性至弱碱性pH 7-8,这样的条件下结合,经常使用磷酸钠缓冲液。也可以使用Tris-HCl,但是在金属-蛋白质亲和力非常弱的情况下应该避免,因为它可以降低结合强度,在缓冲液中避免螯合剂如EDTA或柠檬酸盐的存在。
如果重组组氨酸标签蛋白表达为包涵体,则在所有缓冲液中包括高达6M Gua-HCl或8M尿素。当使用高浓度的尿素或Gua-HCl时,通常发生蛋白质解折叠。包涵体变性复性是个很复杂的过程,一般的建议纯化可溶蛋白。
提示:含有尿素的样品可以通过SDS-PAGE直接分析,而含有Gua-HCl的样品在SDS-PAGE之前必须用尿素缓冲液置换缓冲液。
3.1 缓冲液制备
用于缓冲液制备的水和化学品应具有高纯度。使用前通过0.45μm过滤器过滤缓冲液。 使用高纯度咪唑,因为这将在280nm处产生非常低的吸光度或没有吸光度。
推荐缓冲液
结合缓冲液:20mM磷酸钠,0.5M NaCl,20-40mM咪唑,pH 7.4(最佳咪唑浓度是依蛋白质性质而定的,20-40mM适用于许多蛋白质)。
洗脱缓冲液:20mM 磷酸钠,0.5M NaCl,500mM 咪唑,pH 7.4(洗脱所需的咪唑浓度是依蛋白质性质而定的)。
3.2 装柱
(1)让所有的材料和试剂达到室温。配制初始缓冲液(平衡液)和洗脱缓冲液。
(2)根据柱子大小取所需量的凝胶,用去离子水清洗掉 20%乙醇,用初始缓冲液(按凝胶:缓冲液=3:1 的比例)配成匀浆。
(3)将柱内及柱子底端用水或缓冲液润湿并保持一小段液位,务必使底端无气泡。
(4)用玻璃棒引导匀浆沿着柱内壁一次性倒入柱内,注意勿使产生气泡。打开柱子出液口,使凝胶在柱内自由沉降,连结好柱子顶端柱头。
(5)打开蠕动泵,让缓冲液用使用时流速的 1.33 倍的流速流过,使柱床稳定(注意压力不要超过填料最大耐压)。
3.3 样品的制备
样品应完全溶解。为了避免堵塞层析柱,我们建议通过0.45μm过滤器进行离心和过滤,以去除细胞碎片或其他颗粒物质。
3.4 平衡色谱柱
用5-10个柱体积的结合缓冲液平衡该柱,直到流出液电导和pH不变。
3.5 上样
(1)样品用平衡液配制,样品一定要离心或过滤后上样。盐浓度太大的样品需要处理后再配。
(2)一般情况是让目标产品结合在柱子上,用平衡液洗去杂质和没有结合的蛋白,再选择一种洗脱液洗下目标产品。
3.6 洗脱
用洗脱缓冲液使用阶梯梯度或线性梯度洗脱。对于洗脱步骤,5个柱体积的洗脱缓冲液通常就足够了。对于线性梯度洗脱,适当增加洗脱步骤。
注意:当手动测量吸光度时,使用洗脱缓冲液作为空白。 如果需要从蛋白质中去除咪唑,使用脱盐柱或透析手段。
3.7 手动操作
1) 轻轻摇动装有Ni-琼脂糖凝胶6FF的瓶子,直到介质均匀。
2) 从瓶中取出2ml浆液,并转移到离心管中。
3) 3.500×g离心5分钟沉淀Ni-琼脂糖凝胶6FF。
4) 弃去上清液,并换成5ml蒸馏水。
5) 轻轻摇动Ni-琼脂糖凝胶6FF,3分钟,并通过在500×g离心5分钟来分离。
6) 使用结合缓冲液代替蒸馏水重复步骤4和5,至少3-5次。
7) 将Ni-琼脂糖凝胶6FF转移到量筒。
8) 加入适当体积的结合缓冲液以制备50%浆液。
9) 将4ml样品加入1ml 50%浆液中。Ni-琼脂糖凝胶6FF的结合能力是依据蛋白质的性质不同而不同的,平均值为20-40mg/ml。这意味着1ml的50%浆液可以结合大约10-20mg组氨酸标记的蛋白质。
10) 将样品和Ni-琼脂糖凝胶6FF浆液在室温下在摇床上低速孵育1小时。
11) 用2×1ml结合缓冲液洗涤并收集两种组分。
12) 用4×0.5ml洗脱缓冲液洗脱,并将洗脱的组分收集在四个单独的管中。
13) 使用分光光度计测量280nm处的吸光度,并通过SDS-PAGE确认各组分的纯度。使用洗脱缓冲液作为空白。
4. 可能的问题
4.1 柱子堵塞
(1)样品中的细胞碎片可能堵塞色谱柱。
(2)通过0.22μm或0.45μm过滤器离心和/或过滤样品。
4.2 洗脱液中没有发现组氨酸标签蛋白
(1)洗脱条件太温和(组氨酸标记的蛋白质仍然结合):用增加咪唑的浓度或降低pH洗脱以确定最佳洗脱条件。
(2)样品或结合缓冲液中咪唑的浓度太高,影响了his蛋白质的结合,这时,需要降低样品或结合缓冲液中咪唑浓度。
(3)靶蛋白可能不是预期的组氨酸标签蛋白:验证DNA序列。
(4)组氨酸标签可能未充分暴露,所以没有结合到填料上。
(5)对于包涵体,在蛋白质的变形复性过程中,活性丧失。尽量选择可溶性蛋白进行纯化。
(6)缓冲液或样品组成不正确:检查样品和结合缓冲液的pH和组成,确保溶液中螯合剂或强还原剂以及咪唑的浓度不要太高。
4.3 洗脱的蛋白质不纯
如果杂蛋白对镍离子同样具有高亲和力,这时需要优化结合缓冲液的咪唑浓度,如果优化条件除不去杂蛋白,可能需要通过离子交换层析或凝胶过滤进一步纯化。
5 再生
注意:如果要纯化相同的蛋白质,则不必在每次纯化之间去再生,在5-7次纯化后再生就足够了。为了重新对Ni-琼脂糖凝胶6FF挂Ni2+,首先除去残留的Ni2+:
(1)用 20mM 磷酸缓冲液,0.5M NaCl,50mM EDTA,pH 7.4,冲洗柱子,洗 5 个柱体积,以洗去残留的 Ni2+离子;
(2)用至少 5 倍柱体积的蒸馏水洗柱子,以彻底清洗掉残留的 EDTA;
(3)用 0.1M NiSO4过柱子,2-5 个柱体积;(4)用至少 5 倍柱体积的蒸馏水洗柱子,以彻底清洗没有结合的 Ni2+离子;
(5)用 20%的乙醇过柱子,让填料保存在 20%的乙醇环境中。
6 在位清洗(CIP)
(1)当看到背压增加时,就应该清洗色谱柱,对柱子重新挂镍再生。
(2)除去离子交换作用吸附的蛋白,用2~3倍柱床体积2M NaCl溶液淋洗柱子,再反向淋洗,最后用水彻底清洗。
7 保存
使用完的填料,用纯水彻底冲洗,最后保存在 20%乙醇中,4℃保存。
注意事项:
1.上样之前,样品必须经过膜过滤及去除色素,否则杂质及色素会被吸附到填料上,影响填料的正常使用。
2.在使用过程中,避免使用高浓度的强酸强碱,酸和碱的浓度应低于 0.1 摩尔。碱会使流速变慢。
3.不同的样品,吸附和洗脱方法不相同,可以根据相关的文献进
-
 说明书下载.pdf
说明书下载.pdf



