上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
- 产品参数
- 产品详情
Cell Meter 细胞凋亡和细胞坏死检测试剂盒 三色荧光

简要概述
Cell Meter 细胞凋亡和细胞坏死检测试剂盒 三色荧光是美国AAT Bioquest研发的用于细胞凋亡和坏死检测的试剂盒,该特定试剂盒旨在同时监测细胞凋亡,坏死和健康。细胞凋亡是一种自主细胞拆解的活跃程序化过程,可避免引发炎症。在细胞凋亡中,磷脂酰丝氨酸(PS)被转移到质膜的外部小叶。作为细胞凋亡的初始/中间阶段的通用指标,可以在观察到形态变化之前检测细胞表面上磷脂酰丝氨酸的出现。该试剂盒中使用的PS传感器在与膜PS结合后具有绿色荧光(Ex / Em = 490 / 525nm)。坏死已被描述为由于环境扰动导致的被动,意外细胞死亡,其中炎性细胞内容物不受控制地释放。如通过膜不可渗透的7-AAD(Ex / Em = 546 / 647nm)标记细胞核的能力所证明的,质膜完整性的丧失代表了证明晚期细胞凋亡和坏死的直接方法。此外,该试剂盒还提供活细胞质标记染料,CytoCalcein Violet 450(Ex / Em = 405/450 nm),用于标记活细胞的细胞质。该试剂盒经过优化,可用流式细胞仪或荧光显微镜同时检测细胞凋亡(绿色),坏死(绿色和/或红色)和健康细胞(蓝色)。金畔生物是AAT Bioquest 的中国代理商,为您提供优质的细胞凋亡和坏死检测试剂盒。
产品说明书
样品分析方案
概述
用测试化合物(200μL/样品)制备细胞
添加Apopxin Green测定溶液
在室温下孵育30-60分钟
用流式细胞仪或荧光显微镜分析
在Ex / Em = 490 / 525nm(细胞凋亡),550 / 650nm(坏死)和405 / 450nm(健康细胞)
操作步骤
1.用Apopxin Green制备和孵育细胞:
1.1用测试化合物将细胞维持一段所需的时间(用星形孢菌素处理的Jurkat细胞4-6小时)以诱导细胞凋亡。
1.2离心细胞,得到1-5×105个细胞/管。
1.3将细胞重悬于200μL测定缓冲液(组分B)中。
1.4将2μLApopxin Green(组分A)加入细胞中。
可选1:将1μL的200X 7-AAD(组分C)加入细胞中用于坏死细胞。
可选2:将100μLDMSO加入到CytoCalcein Violet 450(组分D)的小瓶中,得到200X CytoCalcein Violet 450原液,然后向细胞中加入1μL进行健康细胞染色。
1.5在室温下孵育30至60分钟(避光)。
1.6在用流式细胞仪或荧光显微镜分析细胞之前,加入300μL测定缓冲液(组分B)以增加体积(参见下面的步骤1.7)。
1.7使用流式细胞仪或荧光显微镜观察Ex / Em = 490 / 525nm处荧光强度的细胞凋亡,550 / 650nm处坏死,以及405/450nm处的健康细胞(参见下面的步骤2或3)。
2.使用流式细胞仪分析细胞:
使用FL1通道(Ex / Em = 490/525 nm)定量Apopxin Green结合,并在添加7-AAD时使用FL3通道(Ex / Em = 490/650 nm)测量细胞活力,和/或 当将CytoCalcein Violet 450加入细胞中时,使用Ex / Em = 405 / 450nm。
注意:Apopxin 与贴壁细胞结合的流式细胞术分析未经常检测,因为在细胞分离或收获期间可能发生特定的膜损伤。 然而,Casiola-Rosen等人先前报道了利用膜联蛋白V对贴壁细胞类型进行流式细胞术的方法。 和van Engelend等人(见参考文献1和2)。
3.使用荧光显微镜分析细胞:
3.1从步骤1.5中移取细胞悬液,用测定缓冲液冲洗1-2次,然后用测定缓冲液重悬细胞。将细胞添加到载玻片盖玻片或黑色墙壁/透明底96孔微孔板的载玻片上。
注意:对于贴壁细胞,建议直接在盖玻片(或黑墙/透明底96孔微孔板)上培养细胞。与Apopxin Green孵育(步骤1.5)后,用测定缓冲液冲洗1-2次,然后将测定缓冲液加回到盖玻片(或黑色壁/透明底96孔微孔板)中。在玻璃载玻片上翻转盖玻片并观察细胞。在与Apopxin Green温育后,细胞也可以固定在2%甲醛中,并在显微镜下观察。
3.2使用FITC通道在荧光显微镜下用Apopxin Green分析凋亡细胞。当添加7-AAD时使用德克萨斯红色通道测量细胞活力,和当将CytoCalcein Violet 450添加到细胞中时测量/或紫色通道。质膜上的绿色染色表明Apopxin Green与细胞表面的PS结合。
数据分析
在活的非凋亡细胞中,Apopxin Green检测非诱导细胞中的先天性细胞凋亡,其通常为所有细胞的2-6%。在凋亡细胞中,Apopxin Green与磷脂酰丝氨酸结合,磷脂酰丝氨酸位于细胞膜的外部小叶上,导致染色强度增加。
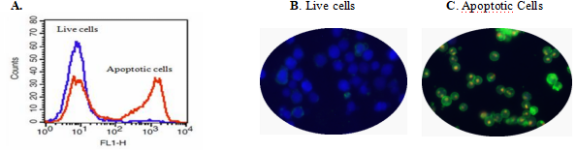
图1.在Jurkat细胞中检测Apopxin Green与磷脂酰丝氨酸的结合活性。 A.在37℃,5%CO 2培养箱中不用(A.蓝色)或用1μM星形孢菌素(A.Red)处理Jurkat细胞5小时,然后加载Apopxin Green 30分钟。使用FL1通道,用FACSCalibur(Becton Dickinson,San Jose,CA)流式细胞仪测量Apopxin Green的荧光强度。 B和C:荧光图像显示活细胞(蓝色,CytoCalcein Violet 450染色),细胞凋亡(绿色,Apopxin Green染色)和Jurkat细胞坏死(红色,7-AAD染色指示)用1μM星形孢菌素处理3小时。用Olympus荧光显微镜分别通过Violet,FITC和TRITC通道拍摄细胞的荧光图像。如上所示,合并来自相同细胞群的每个通道的各个图像。 B:非诱导对照细胞; C:星形孢菌素诱导的细胞的三重染色。

